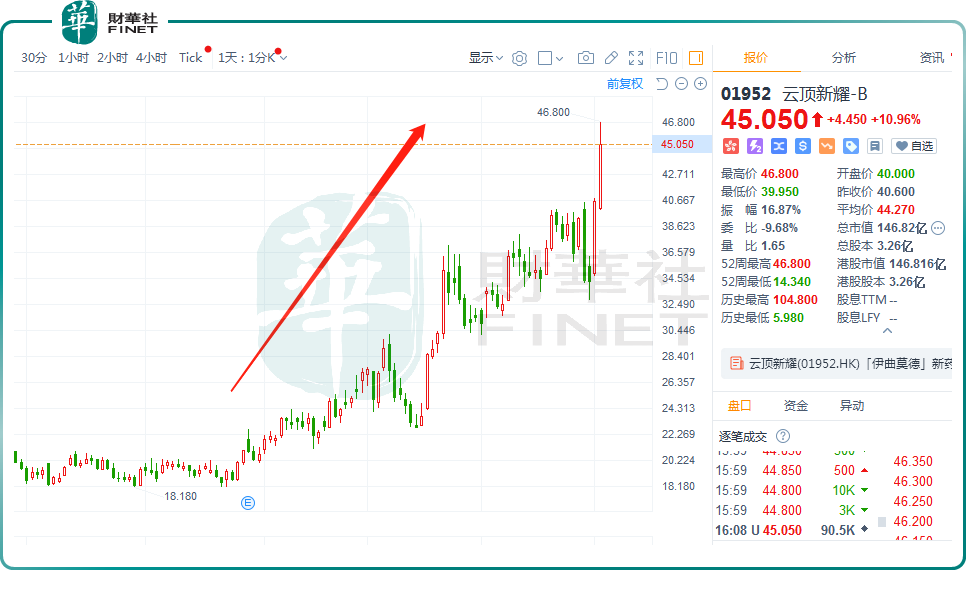
12月3日,云顶新耀-B(01952.HK)延续近期上涨势头,盘中最高飙涨15.27%。截至收盘,其股价涨幅为10.96%,报45.05港元。
拉长周期看,自8月下旬至今,该股走势颇为陡峭,区间累计涨幅达1.4倍;年内累涨115.55%,表现优于同行,引发市场广泛关注。
资料显示,云顶新耀已发展成为一家从早期研发、临床开发、注册、生产到商业化的全产业链综合性生物制药公司,其研发领域包括肾科疾病、mRNA技术、感染性及传染性疾病、自身免疫性疾病等。
深入分析,云顶新耀股价所呈现出的高涨态势,这背后固然有整体行情的因素,但更重要的是公司新产品商业化提速,进一步增强了市场对云顶新耀未来业绩的乐观预期。
消息面上,近期,云顶新耀公司旗下两款重磅产品,耐赋康®和伊曲莫德,均取得了重要进展。
11月28日,云顶新耀宣布耐赋康(布地奈德肠溶胶囊,NEFECON)成功纳入国家医保药品目录。新版国家医保药品目录将于2025年1月1日起正式生效。
耐赋康为全球首个获得美国食品药品监督管理局和欧洲药品管理局完全批准的IgA肾病治疗药物,于2023年11月通过优先审评程序正式获得中国国家药品监督管理局批准,用于治疗原发性IgA肾病的成年患者,是中国唯一获得IgA肾病适应症的治疗药物。
资料显示,IgA肾病是我国最常见的原发性肾小球疾病,以18-45岁的青壮年为主要发病人群。目前我国约有500万IgA肾病患者,且每年新增确诊患者超过10万人。这是一个极其庞大的治疗市场基础。
纳入医保目录后,耐赋康的放量逻辑将愈发清晰,即以更高的可负担性,惠及更多患者。可以预见,明后年销售将会加速放量,有望助力公司业绩提升。
此外,云顶新耀在自免疫领域的重磅药品——伊曲莫德(VELSIPITY)也即将迎来收获期。
近日,云顶新耀宣布伊曲莫德(VELSIPITY)用于治疗中重度活动性溃疡性结肠炎成人患者的新药上市许可申请,已获得香港卫生署正式受理。该产品已于今年4月获得澳门药物监督管理局批准上市,并于10月份通过“港澳药械通”政策在大湾区落地。
伊曲莫德,是欧盟首个且唯一获批用于16岁及以上患者的新一代口服治疗中重度活动性溃疡性结肠炎药物,也是目前唯一在全球Ⅲ期临床试验中证实对孤立性直肠炎有疗效的药物。
近年来,溃疡性结肠炎在我国发病率明显增加,预计到2030年,中国的溃疡性结肠炎患者人数预计将达到约100万人,存在迫切且巨大的未被满足的临床需求。
华福证券表示,伊曲莫德很大潜力成为中国中度至重度溃疡性结肠炎的一线治疗药物,可口服给药,无安全性黑框标签,展现出与生物制剂相当的临床疗效,预计24 年内在中国内地递交NDA 申请。
需要指出的是,虽然云顶新耀在产品线方面频频迎来好消息,但其依旧未摆脱亏损,且上半年亏损进一步扩大。
根据财务数据显示,2024年上半年,云顶新耀收入3.02亿元,同比增长高达32.9倍。尽管公司收入大幅增长,但其仍深陷亏损泥淖。期内,其录得归母净亏损约6.32亿元,而上年同期则亏损4.24亿元,亏损进一步扩大。
不过,对于生物医药企业而言,早期往往依赖于大量的研发投入,初期亏损并不代表未来业绩不会改善。
展望后市,伴随着多款重磅产品商业化持续提速,市场普遍认为,云顶新耀的业绩有望迎来持续增长,逐渐实现扭亏为盈。
